2021年3月31日新葡萄8883官网AMG潘建平教授团队在病原生物学领域国际顶级期刊PLoS Pathogens在线发表了题为“TcpC inhibits toll-like receptor signaling pathway by serving as an E3 ubiquitin ligase that promotes degradation of myeloid differentiation factor 88”的研究论文。该研究发现尿路致病性大肠埃希菌(uropathogenic E. coli, UPEC)毒力因子TcpC是一种E3泛素连接酶,可以通过促进MyD88泛素化降解,阻断TLR信号通路,抑制巨噬细胞介导的固有免疫功能,揭示了病原菌逃逸机体固有免疫应答的新机制。
以往研究发现,TcpC因含有TIR结构域,可以直接与TLR竞争结合MyD88,抑制TLR介导的信号途径,从而抑制巨噬细胞的活化和杀菌功能,利于UPEC在体内的存活,与UPEC所致肾盂肾炎等尿路感染的发生、发展密切相关。
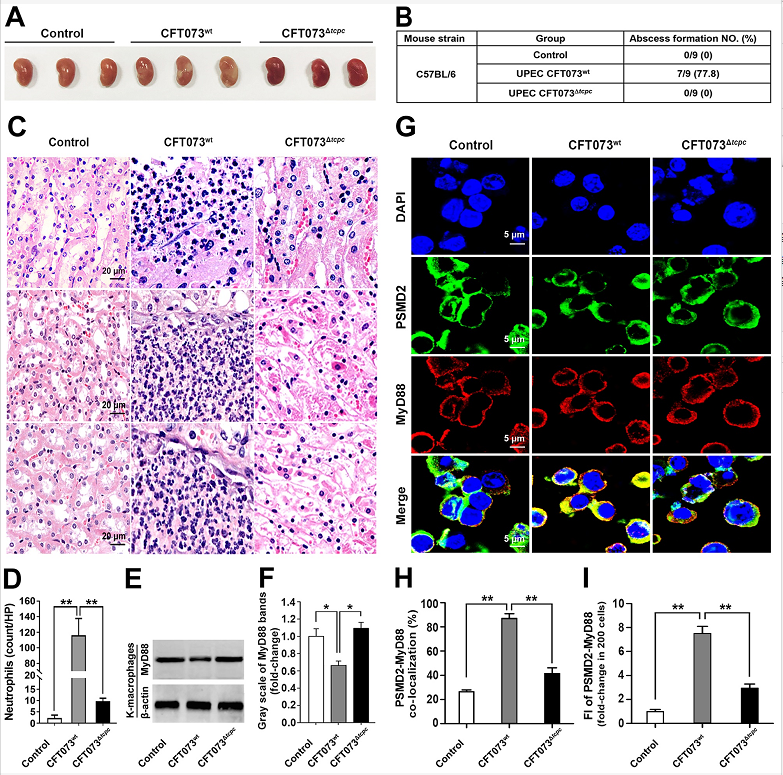
本研究发现,在小鼠肾盂肾炎模型中,与敲除tcpc基因的CFT073突变株(CFT073Δtcpc)组相比,分泌TcpC的CFT073野生株(CFT073wt)组肾脏出现明显的脓肿和显著的中性粒细胞浸润(图1A-D);CFT073wt组肾脏巨噬细胞内MyD88蛋白水平显著下降(图1E-F)、胞内MyD88与蛋白酶体标志物(PSMD2)的共定位显著增多(图1G-I)。
图1. 肾盂肾炎模型小鼠肾脏巨噬细胞MyD88水平以及与蛋白酶体共定位情况
作者以人巨噬细胞系THP-1、小鼠巨噬细胞系J774A.1和RAW264.7为细胞模型,研究基因重组TcpC蛋白(rTcpC)对巨噬细胞MyD88表达的影响。结果发现,rTcpC能剂量依赖性地抑制巨噬细胞MyD88蛋白水平,但不影响其mRNA水平,提示TcpC能促进MyD88降解。
泛素化是蛋白质翻译后修饰的重要方式之一,在蛋白质降解、应激反应、细胞周期调节、蛋白质运输、信号转导和转录调节等过程中发挥重要作用。泛素化过程由一个或多个泛素分子在泛素激活酶(E1)、泛素结合酶(E2)、泛素连接酶(E3)的共同作用下与其它蛋白质分子共价结合并通常降解这些蛋白质。
作者观察了rTcpC对巨噬细胞MyD88泛素化水平的影响,结果显示,rTcpC处理能显著增强巨噬细胞MyD88泛素化水平。生物信息学分析提示TcpC含有HECT家族E3泛素连接酶所具有的结构特征,而人和小鼠MyD88含有HECT家族E3泛素连接酶底物所具有的P-Y基序,提示TcpC可能是一种新的E3泛素连接酶。随后的体外泛素化实验证明rTcpC是一种能促进MyD88泛素化的E3泛素连接酶。
为了明确与TcpC结合的E2,作者用抗TcpC抗体Pull-down巨噬细胞中能rTcpC结合的蛋白,获得PSM>10的4个条带,经LC-MS/MS分析证实,其中2种蛋白分别是UBE2D1(一种E2)和MyD88。表面等离子共振和等温滴定量热法检测显示,rTcpC能与UBE2D1和MyD88高亲和力结合。
定点突变研究显示,TcpC中C12和W106是维持其E3泛素化连接酶活性的关键位点。
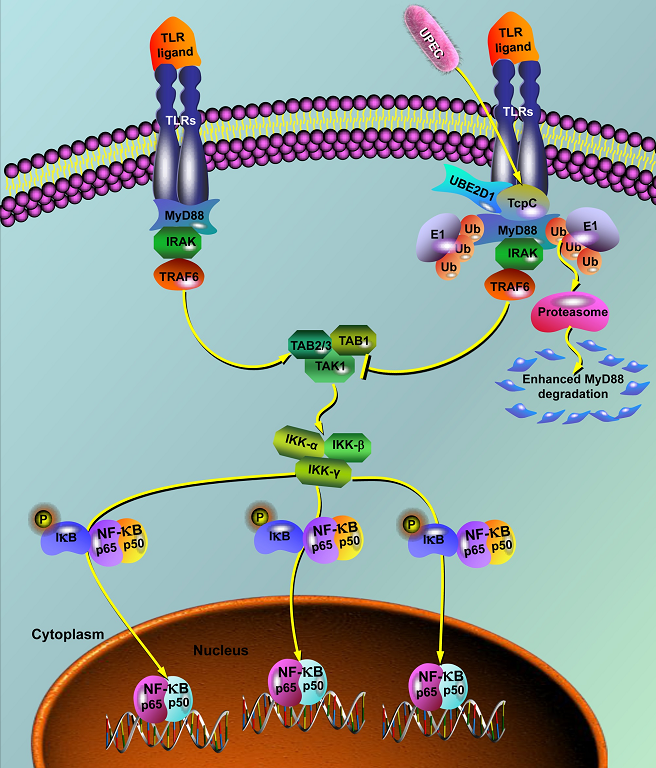
该发现不仅为进一步阐明UPEC的致病性提供了新的实验依据,而且也是病原菌来源的毒力因子作为E3泛素连接酶,促进MyD88泛素化降解,阻断TLR信号通路,从而抑制固有免疫细胞活化的首次报道,为进一步阐明病原菌免疫逃逸机制提供了新的线索,具有重要的学术价值。
图2. TcpC阻断TLR信号通路分子机制示意图
博士后方佳琪、硕士生欧茜和博士生潘鋆为论文的共同第一作者,新葡萄8883官网AMG潘建平教授、德国海德堡大学Thomas Miethke教授为论文的共同通讯作者。
该研究受到了国家自然科学基金面上项目、浙江省自然科学基金、中国博士后科学基金面上项目的资助。
潘建平教授课题组供稿![]()